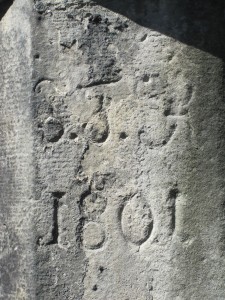Als chemische Verwitterung bezeichnet man alle Vorgänge, bei denen Gesteine gelöst, oder in eine andere Form überführt werden. Hierbei spielt Wasser als Lösungsmittel und Träger der Säuren stets eine bedeutende Rolle. Alle chemischen Reaktionen sind außerdem temperaturabhängig. Bei Erhöhung der Temperatur ist die Reaktionsgeschwindigkeit erhöht. Die am häufigsten auftretende chemische Erosion ist die Lösung von Kalk und Kalksteinen durch Kohlensäure (H2CO3), die Kohlensäureverwitterung. Kohlensäure bildet sich aus dem Kohlendioxid (CO2), das durch Regen aus der Luft ausgewaschen wird und auch bei der Zersetzung von tierischen und pflanzlichen Resten innerhalb des Bodens ins Wasser abgegeben wird. Die Säure entsteht durch Lösung des CO2 in Wasser. Das unterirdisch weiterfließende Regenwasser trägt die Säure mit sich. In Kalkgebieten, wo sehr mächtige Kalksteinschichten vorkommen, beispielsweise im Gebirgszug des Jura können allein durch Lösung der Kalkschichten im Laufe der Zeit großräumige und weitläufige Höhlensysteme entstehen, wie z.B. im Jura der fränkischen Schweiz in Nordbayern oder im Frankreich. Diese Form der chemischen Verwitterung nennt man Karst. Auch Sandsteine sind von der Verkarstung betroffen, da die Sandkörnchen aus Quarz und Feldspat aus denen sie meist bestehen oft mit kalkigem Zement verklebt sind.
CaCO3(Kalk) + H2CO3 (Kohlensäure) –> Ca(HCO3)2 (Zement)
Eine weitere Form der Säureverwitterung ist die Rauchgasverwitterung. Die Säuren entstehen aus Schwefeldioxid (SO2) und Stickstoffoxiden (NO2, NO3), die aus Abgasen der Öl und Kohleverbrennung stammen. Schwefelsäure (H2SO4) und Salpetersäure (HNO3) entstehen wie die Kohlensäure durch Lösung der Ausgangsstoffe im Regenwasser. Vor allem in Städten ist die Rauchgasverwitterung an Häuserwänden u.a. zu beobachten. An historischen Gebäuden und Statuen wird sie zunehmend zu einem ernsthaften Problem.
SO2 (Schwefeldioxid) + 2 H2O (Wasser) –> H3O+ (Hydronium-Ion) + HSO3– (schweflige Säure)